Tìm hiểu phản ứng cộng là gì trong hóa hữu cơ: định nghĩa, phân loại, cơ chế ái lực điện tử và hạt nhân, ví dụ minh họa và bảng so sánh chi tiết.
I. Phản ứng cộng là gì?
Phản ứng cộng thường gặp trong công nghiệp và đời sống, chẳng hạn như quá trình hydro hóa dầu ăn để tạo bơ thực vật, hoặc trong tổng hợp các chất hữu cơ như rượu, dẫn xuất halogen. Đây là nền tảng để hiểu các phản ứng hữu cơ quan trọng hơn như trùng hợp, thế hay oxi hóa.
Phản ứng cộng là gì? (ảnh minh họa cơ chế phản ứng cộng HCl)
1. Định nghĩa phản ứng cộng
Phản ứng cộng là phản ứng trong đó hai hay nhiều phân tử kết hợp với nhau để tạo thành một phân tử duy nhất.
Phản ứng cộng là loại phản ứng đặc trưng trong hóa học hữu cơ, đặc biệt phổ biến với các hợp chất chứa liên kết đôi hoặc ba (như anken, ankin, ankadien). Trong phản ứng này, hai phân tử hoặc nhóm nguyên tử sẽ cộng trực tiếp vào nhau để tạo ra một sản phẩm duy nhất mà không sinh ra chất phụ.
2. Điều kiện xảy ra phản ứng cộng
Chất tham gia có liên kết π (pi) yếu dễ bị tấn công (thường là liên kết đôi hoặc ba).
Thường xảy ra trong điều kiện xúc tác hoặc ánh sáng, tùy loại phản ứng.
3. Đặc điểm của phản ứng cộng
Xảy ra chủ yếu ở các phân tử có liên kết π (pi yếu, dễ bị đứt).
Không tạo sản phẩm phụ như phản ứng thế.
Có thể theo nhiều cơ chế khác nhau (ái lực điện tử, ái lực hạt nhân).
4. Ví dụ về phản ứng cộng
Cộng H₂ vào etilen (C₂H₄):
CH2=CH2 + H2 —(Ni,t°)→ CH3−CH3
👉 Etilen cộng H₂ tạo thành etan.
Cộng Br₂ vào etilen:
CH2=CH2 + Br2 → CH2Br−CH2Br
👉 Dung dịch brom mất màu → phản ứng dùng để nhận biết liên kết đôi.
Cộng HCl vào propin (C₃H₄):
CH≡CCH3 + HCl → CH2=CHCl−CH3
👉 Phản ứng cộng vào liên kết ba, sau đó có thể tiếp tục cộng.
5. Các loại phản ứng cộng phổ biến
| Loại phản ứng cộng | Ví dụ | Đặc điểm |
|---|---|---|
| Cộng halogen (Br₂, Cl₂) | C₂H₄ + Br₂ → C₂H₄Br₂ | Dùng để nhận biết liên kết đôi |
| Cộng hidro (H₂) | C₂H₄ + H₂ → C₂H₆ | Xảy ra trong xúc tác (Ni, Pd) |
| Cộng HX (HCl, HBr…) | CH₂=CH₂ + HCl → CH₃-CH₂Cl | Theo quy tắc Markovnikov |
| Cộng H₂O (phản ứng hiđrat hóa) | CH₂=CH₂ + H₂O → CH₃-CH₂OH | Trong điều kiện acid H⁺ |
I. Phân loại phản ứng cộng trong hóa học hữu cơ
Phản ứng cộng trong hóa học hữu cơ có thể chia thành nhiều loại, tùy thuộc vào chất phản ứng và điều kiện xúc tác. Dưới đây là các kiểu phản ứng cộng phổ biến nhất, mỗi loại đều có vai trò quan trọng trong đời sống và tổng hợp hữu cơ.
1. Phản ứng cộng hiđro (Hydro hóa)
Phản ứng cộng H₂ xảy ra với các hợp chất chứa liên kết đôi hoặc ba (như anken, ankin), có xúc tác kim loại như Ni, Pt hoặc Pd. Phản ứng thường dùng để chuyển hợp chất không no thành hợp chất bão hòa.
Phương trình tổng quát:
RCH=CH2 + H2 —(Ni, t∘)—> RCH2CH3
Ví dụ minh họa:
CH2=CH2 + H2 —(Ni)—> CH3–CH3 (etilen → etan)
CH3–C≡CH + 2H2 —(Ni)—> CH3–CH2–CH3 (propin → propan)
CH2=CH–CH=CH2 + 2H2 —(Ni)—> CH3–CH2–CH2–CH3 (buta-1,3-đien → butan)
2. Phản ứng cộng halogen (Cl₂, Br₂)
Phản ứng cộng halogen là một phương pháp nhanh và phổ biến để kiểm tra sự có mặt của liên kết đôi, vì dung dịch brom (Br₂) mất màu nâu đỏ khi xảy ra phản ứng.
Phương trình tổng quát:
RCH=CH2 + X2 → RCHX–CH2X
Ví dụ minh họa:
CH2=CH2 + Br2 → CH2Br–CH2Br (etilen + brom)
CH3–CH=CH2 + Cl2 → CH3–CHCl–CH2Cl (propen + clo)
CH2=CH–CH=CH2 + 2Br2 → CH2Br–CHBr–CHBr–CH2Br (buta-1,3-đien + brom)
3. Phản ứng cộng HX (HCl, HBr, HI)
Phản ứng cộng hiđro halogenua vào liên kết đôi xảy ra theo quy tắc Maccopnhicop: “Nguyên tử H sẽ cộng vào carbon có nhiều H hơn, còn halogen cộng vào carbon bậc cao hơn”.
Phương trình tổng quát:
RCH=CH2 + HX → RCHX–CH3
Ví dụ minh họa:
CH2=CH–CH3 + HBr → CH3–CHBr–CH3 (propen + HBr)
CH2=CH2 + HCl → CH3–CH2Cl (etilen + HCl)
CH3–CH=CH2 + HCl → CH3–CHCl–CH3 (áp dụng quy tắc Maccopnhicop)
4. Phản ứng cộng nước (Hydrat hóa)
Anken có thể cộng nước trong điều kiện có xúc tác axit (thường là H₂SO₄ loãng, đun nóng), tạo ra rượu tương ứng. Phản ứng này tuân theo quy tắc Maccopnhicop tương tự cộng HX.
Phương trình tổng quát:
RCH=CH2 + H2O —(H+)→ RCH(OH)–CH3
Ví dụ minh họa:
CH2=CH2 + H2O —(H+)→ CH3–CH2OH (etilen → etanol)
CH3–CH=CH2+H2O —(H+)→CH3–CH(OH)–CH3 (propen → isopropanol)
CH2=CH–CH3 + H2O —(H+)→ CH3–CH(OH)–CH3 (propen → propan-2-ol)
5. Phản ứng cộng ankađien (dien cộng hợp)
Ankađien có hai liên kết đôi, có thể tham gia cộng theo 2 kiểu:
Cộng 1,2: phản ứng xảy ra ở liên kết đôi đầu tiên.
Cộng 1,4: phản ứng mở rộng liên kết, tạo sản phẩm bền hơn.
Ví dụ minh họa:
CH2=CH–CH=CH2 + Br2 → CH2Br–CH=CH–CH2Br (cộng 1,4)
CH2=CH–CH=CH2 + HBr → CH3–CH=CH–CH2Br (cộng 1,4 – sản phẩm chính)
CH2=CH–CH=CH2 + 2H2 → CH3–CH2–CH2–CH3 (hydro hóa hoàn toàn)
Phản ứng cộng ankađien là cơ sở cho các phản ứng trùng hợp tạo cao su thiên nhiên và cao su tổng hợp.
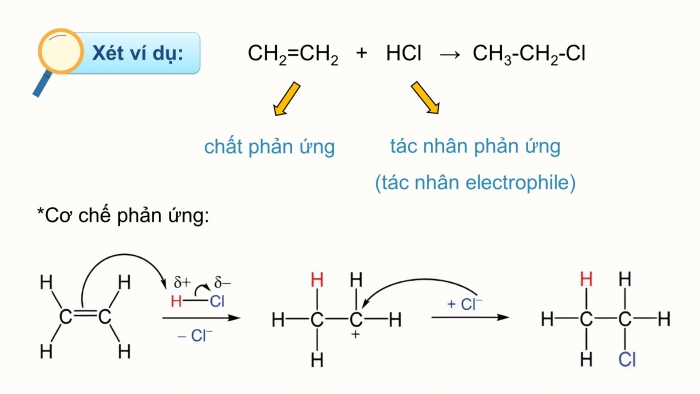
III. Cơ chế phản ứng cộng: điện tử và hạt nhân
Phản ứng cộng diễn ra theo hai cơ chế chính:
1. Phản ứng cộng ái lực điện tử (Electrophilic addition)
Xảy ra với các hợp chất có liên kết đôi, liên kết ba (C=C, C≡C).
Gồm hai bước: tạo carbocation → anion tấn công.
Áp dụng quy tắc Maccopnhicop.
Ví dụ: CH3–CH=CH2+HBr→CH3–CHBr–CH3
2. Cộng ái lực hạt nhân (Nucleophilic addition)
Gặp ở hợp chất chứa nhóm C=O như andehit, xeton.
Hạt nhân tấn công C mang điện tích dương → mở liên kết đôi.
Ví dụ: CH3CHO+HCN→CH3CH(OH)CN
Việc nắm được hai cơ chế này giúp học sinh hiểu rõ quy luật phản ứng và áp dụng trong các dạng bài tập vận dụng.
IV. So sánh phản ứng cộng – phản ứng thế – phản ứng trùng hợp
Dưới đây là bảng so sánh giúp bạn phân biệt ba loại phản ứng hữu cơ thường gặp:
| Tiêu chí | Phản ứng cộng | Phản ứng thế | Phản ứng trùng hợp |
|---|---|---|---|
| Loại hợp chất tham gia | Hợp chất không no (C=C) | Hợp chất bão hòa, thơm | Monome có liên kết π |
| Đặc điểm phản ứng | Cộng trực tiếp vào phân tử | Thay thế một nhóm thế | Lặp lại phản ứng cộng |
| Sản phẩm | Một sản phẩm duy nhất | Có sản phẩm phụ | Polymer |
| Ví dụ | C₂H₄ + H₂ → C₂H₆ | CH₄ + Cl₂ → CH₃Cl + HCl | nCH₂=CH₂ → –[CH₂–CH₂]–ₙ |
So sánh này rất quan trọng khi làm bài tập lý thuyết hoặc ôn thi THPT QG. Ngoài ra bạn còn có thể xem bảng so sánh chi tiết hơn bên dưới đây.
| Tiêu chí | Phản ứng cộng | Phản ứng trùng hợp | Phản ứng thế |
|---|---|---|---|
| Khái niệm | Phản ứng trong đó hai hay nhiều chất cộng vào nhau để tạo thành một chất duy nhất, không tạo sản phẩm phụ. | Phản ứng mà nhiều phân tử nhỏ (monomer) liên kết với nhau thành phân tử lớn (polymer). | Phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử bị thay thế bởi nguyên tử hoặc nhóm khác. |
| Điều kiện | Thường xảy ra với liên kết đôi hoặc ba (có liên kết π dễ bị phá vỡ). | Cần xúc tác hoặc nhiệt độ cao, áp suất; dùng cho monomer có liên kết đôi. | Xảy ra với hidrocacbon no hoặc vòng thơm, thường cần ánh sáng hoặc xúc tác. |
| Loại chất tham gia | Anken, ankin, hợp chất không no. | Anken, vinyl clorua, stiren, acrilonitrin,… | Ankan, aren,… |
| Sản phẩm chính | Một hợp chất bão hòa hơn. | Polyme có khối lượng phân tử lớn. | Một sản phẩm mới + sản phẩm phụ (thường là HCl, H₂O,…) |
| Ví dụ phản ứng | CH₂=CH₂ + Br₂ → CH₂Br–CH₂Br | nCH₂=CH₂ → (–CH₂–CH₂–)ₙ (polietilen) | CH₄ + Cl₂ → CH₃Cl + HCl |
| Có sản phẩm phụ? | ❌ Không | ❌ Không | ✅ Có |
| Ứng dụng | Tổng hợp chất mới, nhận biết anken, ankin. | Tạo ra các loại nhựa, cao su tổng hợp. | Tổng hợp dẫn xuất của hidrocacbon. |
V. Câu hỏi trắc nghiệm lý thuyết
Câu 1: Phản ứng nào sau đây là phản ứng cộng?
A. CH₄ + Cl₂ → CH₃Cl + HCl
B. CH₂=CH₂ + H₂ → CH₃-CH₃
C. CH₃CH₂OH → CH₂=CH₂ + H₂O
D. C₂H₂ + O₂ → CO₂ + H₂O
Đáp án: B
Giải thích: Phản ứng cộng là khi H₂ cộng vào liên kết đôi → tạo phân tử lớn hơn.
Câu 2: Dấu hiệu nhận biết phản ứng cộng Br₂ vào anken trong dung dịch là gì?
A. Tỏa nhiệt mạnh
B. Xuất hiện kết tủa trắng
C. Dung dịch mất màu nâu đỏ
D. Có khí bay lên
Đáp án: C
Câu 3: Chọn phát biểu đúng về phản ứng cộng HBr vào anken:
A. Luôn tuân theo quy tắc Markovnikov
B. H luôn cộng vào C mang ít H hơn
C. Không xảy ra nếu không có ánh sáng
D. Cộng HBr chỉ tạo một sản phẩm duy nhất
Đáp án: A Theo quy tắc Markovnikov: H gắn vào C có nhiều H hơn.
Câu 4: Phản ứng cộng H₂ vào liên kết ba cần xúc tác gì?
A. HCl
B. Br₂
C. Ni (nhiệt độ cao)
D. Ánh sáng
Đáp án: C
Câu 5: Trong các phản ứng sau, phản ứng nào không phải phản ứng cộng?
A. C₂H₂ + 2H₂ → C₂H₆
B. C₂H₄ + HCl → C₂H₅Cl
C. C₂H₄ + Br₂ → C₂H₄Br₂
D. CH₄ + Cl₂ → CH₃Cl + HCl
Đáp án: D (Đây là phản ứng thế)
VI. Bài tập tính toán
Câu 6: Cho 2,24 lít etilen (đktc) phản ứng hoàn toàn với brom. Tính khối lượng brom tham gia phản ứng.
CH2=CH2 + Br2 → CH2Br−CH2Br
✅ Giải:
Số mol C₂H₄ = 2,24 / 22,4 = 0,1 mol
Theo PTHH: 1 mol C₂H₄ cần 1 mol Br₂ ⇒ nBr₂ = 0,1 mol
mBr₂ = 0,1 × 160 = 16 gam
Câu 7: Dẫn 6,72 lít H₂ (đktc) qua 2,8 gam C₂H₂ có xúc tác Ni, nhiệt độ. Tính thể tích H₂ còn dư sau phản ứng.
C2H2 + 2H2 → C2H6
✅ Giải:
nC₂H₂ = 2,8 / 26 = 0,1077 mol
Theo PTHH: 1 mol C₂H₂ cần 2 mol H₂ ⇒ nH₂ cần = 2 × 0,1077 = 0,2154 mol
nH₂ ban đầu = 6,72 / 22,4 = 0,3 mol
⇒ H₂ dư = 0,3 – 0,2154 = 0,0846 mol
⇒ V dư = 0,0846 × 22,4 = 1,895 lít
Câu 8: Cho 11,2 lít khí etilen (đktc) phản ứng vừa đủ với HCl. Tính khối lượng sản phẩm tạo thành.
CH2=CH2 + HCl → CH3−CH2Cl
✅ Giải:
nC₂H₄ = 11,2 / 22,4 = 0,5 mol
⇒ n sản phẩm = 0,5 mol
⇒ MCH₃CH₂Cl = 64 g/mol
⇒ m = 0,5 × 64 = 32 gam
Câu 9: Cho 5,6 lít propin (C₃H₄) phản ứng hoàn toàn với H₂. Tính thể tích H₂ cần dùng (đktc).
CH≡CCH3 + 2H2 → CH3CH2CH3
✅ Giải:
nC₃H₄ = 5,6 / 22,4 = 0,25 mol
- Theo PTHH: 1 mol cần 2 mol H₂
⇒ nH₂ = 0,25 × 2 = 0,5 mol
⇒ V = 0,5 × 22,4 = 11,2 lít
Câu 10: Cho hỗn hợp 0,1 mol C₂H₂ và 0,1 mol C₂H₄. Dẫn qua dung dịch Br₂ dư. Tính khối lượng brom phản ứng.
C2H2 + 2Br2 → C2H2Br4C2H4 + Br2 → C2H4Br2
✅ Giải:
C₂H₂: 0,1 mol × 2 = 0,2 mol Br₂
- C₂H₄: 0,1 mol × 1 = 0,1 mol Br₂
⇒ Tổng Br₂ = 0,3 mol
⇒ m = 0,3 × 160 = 48 gam