Trong thế giới hóa học, các nguyên tử không tồn tại đơn lẻ mà luôn có xu hướng kết hợp lại với nhau để tạo thành phân tử hay hợp chất, nhờ vào các liên kết hóa học. Những liên kết này đóng vai trò cực kỳ quan trọng trong việc quyết định cấu trúc, tính chất và hoạt động của các chất. Không chỉ trong hóa học, mà ngay cả trong sinh học – từ cấu trúc xoắn kép của ADN cho đến sự hình thành protein – các loại liên kết cũng góp phần duy trì sự sống và ổn định của các hệ thống sinh học.
Bên cạnh những liên kết mạnh như liên kết ion hay liên kết cộng hóa trị, còn tồn tại một loại liên kết đặc biệt, tuy yếu hơn nhưng lại giữ vai trò không thể thay thế trong nhiều hiện tượng tự nhiên – đó chính là liên kết hidro (hay còn gọi là liên kết hydrogen). Vậy liên kết hidro là gì? Nó hình thành như thế nào và có những đặc điểm gì nổi bật? Hãy cùng khám phá trong phần tiếp theo của bài viết.
I. Liên kết Hidro là gì?
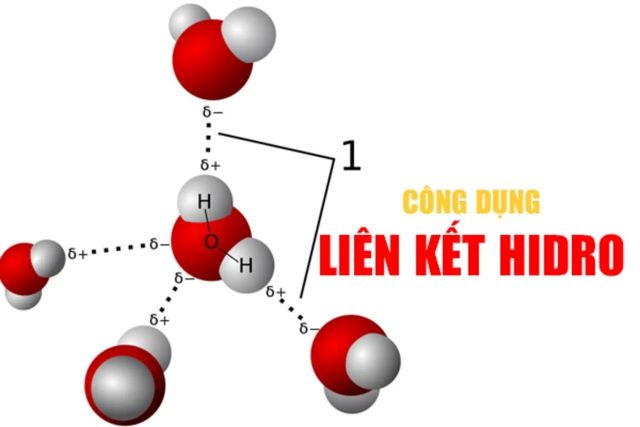
Liên kết hidro (hay còn gọi là liên kết hydrogen) là một loại liên kết yếu, được hình thành giữa nguyên tử hidro (H) đã liên kết cộng hóa trị với một nguyên tử có độ âm điện cao (thường là oxy – O, nitơ – N hoặc flo – F) và một nguyên tử khác cũng có độ âm điện cao ở gần đó. Sự tương tác này xảy ra do hidro mang một phần điện tích dương (δ+), bị hút về phía nguyên tử mang điện tích âm (δ−) của phân tử khác hoặc trong cùng phân tử.
Liên kết Hidro là gì? Đặc điểm và phân loại liên kết H
Nói cách khác, liên kết hidro giống như một “cầu nối” tạm thời, tạo ra sự hút giữa hai phân tử hoặc giữa hai phần của cùng một phân tử, dù lực hút này không mạnh như liên kết hóa học chính thức.
Ví dụ đơn giản:
Trong phân tử nước (H₂O), nguyên tử hidro của phân tử này có thể hình thành liên kết hidro với nguyên tử oxy của phân tử nước khác. Nhờ những liên kết này, các phân tử nước có xu hướng liên kết với nhau thành mạng lưới, giúp nước có nhiều tính chất đặc biệt như: điểm sôi cao, sức căng bề mặt lớn, hay khả năng hòa tan nhiều chất.
II. Liên kết hidro là liên kết yếu hay mạnh?
Một trong những câu hỏi thường gặp khi tìm hiểu về liên kết hidro là: Liên kết hidro là liên kết yếu hay mạnh? Câu trả lời là: liên kết hidro thuộc loại liên kết yếu, nhưng lại mạnh hơn nhiều so với các tương tác phân tử thông thường như lực Van der Waals.
1. So sánh với các loại liên kết khác
| Loại liên kết | Độ bền (kcal/mol) | Ghi chú |
|---|---|---|
| Liên kết cộng hóa trị | ~80–100 | Liên kết mạnh, giữ nguyên tử trong phân tử |
| Liên kết ion | ~100–200 | Liên kết mạnh giữa ion trái dấu |
| Liên kết hidro | ~2–10 | Liên kết yếu nhưng có định hướng |
| Lực Van der Waals | < 2 | Tương tác yếu nhất |
Mặc dù yếu hơn các liên kết hóa học chính thức, liên kết hydrogen lại đóng vai trò đặc biệt quan trọng trong nhiều hiện tượng tự nhiên. Trong sinh học, chính nhờ liên kết H mà cấu trúc xoắn kép của ADN được duy trì ổn định. Trong hóa học, nó ảnh hưởng đến tính chất vật lý của nước và nhiều hợp chất khác.
2. Tại sao liên kết hidro vẫn được xem là “quan trọng”?
Có định hướng: khác với lực Van der Waals, liên kết H có tính định hướng rõ ràng – tạo nên các cấu trúc không gian đặc thù.
Tạo mạng lưới phân tử: trong nước hoặc băng, các phân tử liên kết với nhau qua liên kết hidro tạo thành cấu trúc bền vững.
Thường xuất hiện số lượng lớn: trong ADN hoặc protein, có hàng trăm liên kết H cùng lúc, tạo nên sự ổn định cho phân tử.
👉 Tóm lại: Liên kết hidro là liên kết yếu, nhưng nhờ đặc điểm định hướng và xuất hiện hàng loạt, chúng có ảnh hưởng rất lớn đến cấu trúc và tính chất của nhiều chất trong tự nhiên và sinh học.
III. Đặc điểm của liên kết hydrogen trong phân tử nước
Phân tử nước (H₂O) là ví dụ kinh điển và cũng là minh họa rõ ràng nhất cho liên kết hidro. Trong nước, mỗi nguyên tử oxy mang hai cặp electron không liên kết, còn mỗi nguyên tử hidro lại có thể tạo liên kết hidro với nguyên tử oxy của phân tử khác. Nhờ đó, các phân tử nước không đứng riêng lẻ, mà kết nối với nhau thành một mạng lưới liên kết hydrogen.
1. Cách hình thành liên kết hydrogen trong nước
Một nguyên tử hiđro (H) đã liên kết cộng hóa trị với oxy (O) trong phân tử này.
Đồng thời, nguyên tử H đó cũng bị hút bởi cặp electron chưa dùng của nguyên tử O từ một phân tử nước lân cận.
Từ đó, tạo ra liên kết hidro giữa hai phân tử.
2. Tác động của liên kết hydrogen đến tính chất của nước
Liên kết hydrogen là nguyên nhân chính tạo nên nhiều tính chất đặc biệt của nước mà chúng ta thường thấy trong đời sống:
Điểm sôi và điểm nóng chảy cao bất thường: So với các phân tử có khối lượng phân tử tương đương, nước có điểm sôi cao hơn rất nhiều vì cần năng lượng lớn để phá vỡ các liên kết hidro giữa các phân tử.
Sức căng bề mặt lớn: Liên kết H giữa các phân tử nước tại bề mặt khiến chúng khó bị tách rời – tạo nên hiện tượng như giọt nước hình cầu, nước dâng lên trong ống nhỏ (mao dẫn), hoặc côn trùng “đi trên nước”.
Mật độ thay đổi theo trạng thái: Khi nước đóng băng, các liên kết H sắp xếp các phân tử theo mạng tinh thể mở – khiến nước đá có mật độ thấp hơn nước lỏng, và nổi trên mặt nước.
Khả năng hòa tan cao: Nhờ liên kết hydrogen, nước có thể tương tác với nhiều chất phân cực và ion – trở thành “dung môi vạn năng” trong hóa học và sinh học.
👉 Tóm lại, chính các liên kết hidro giữa các phân tử nước đã mang lại cho nước những tính chất độc đáo, giúp nước trở thành một phần thiết yếu cho sự sống và các phản ứng hóa học trong tự nhiên.
IV. Phân loại liên kết hidro
Liên kết hidro có thể được chia thành hai loại chính: liên kết hidro liên phân tử và liên kết hidro nội phân tử. Mỗi loại liên kết có những đặc điểm và vai trò riêng biệt, đóng góp vào tính chất và cấu trúc của các chất.
1. Liên kết hidro liên phân tử là gì?
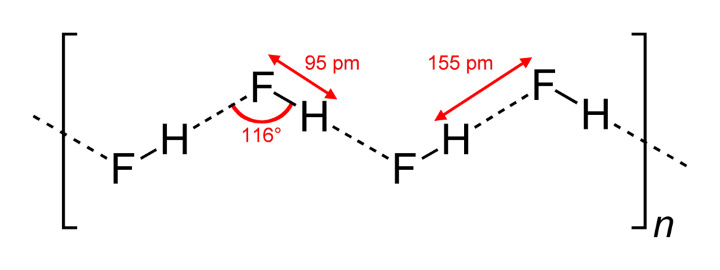
Liên kết hidro liên phân tử là loại liên kết hình thành giữa các phân tử khác nhau. Mỗi phân tử tham gia liên kết đều có một nguyên tử hidro kết hợp với nguyên tử có độ âm điện cao (như oxy, nitơ hoặc flo). Sự tương tác giữa các nguyên tử này tạo ra lực hút yếu giữa các phân tử, nhưng rất quan trọng trong việc quyết định tính chất vật lý của chất.
Liên kết hidro liên phân tử HF
Ví dụ:
Nước (H₂O): Đây là ví dụ điển hình của liên kết hidro liên phân tử. Các phân tử nước liên kết với nhau thông qua liên kết hidro, tạo thành mạng lưới phân tử vững chắc. Điều này giải thích tại sao nước có các tính chất như điểm sôi cao và sức căng bề mặt lớn.
Axit HF: Các phân tử axit HF cũng liên kết với nhau thông qua liên kết hidro, góp phần tạo ra các tính chất đặc biệt như nhiệt độ sôi cao.
2. Liên kết hidro nội phân tử
Liên kết hidro nội phân tử là loại liên kết xảy ra trong cùng một phân tử, giữa nguyên tử hidro và nguyên tử có độ âm điện cao trong phân tử đó. Liên kết này có thể giúp ổn định cấu trúc không gian của phân tử và là yếu tố quan trọng trong việc hình thành các cấu trúc phức tạp của phân tử lớn như protein, ADN.
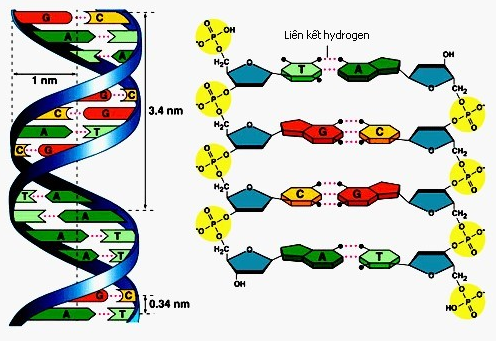
Liên kết hidro nội phân tử trong chuỗi ADN
Ví dụ:
Protein: Trong cấu trúc ba chiều của protein, các liên kết hidro nội phân tử giữa các nhóm amino và carboxyl giúp duy trì hình dạng đặc biệt của protein, ảnh hưởng đến chức năng của chúng.
ADN: Liên kết hidro nội phân tử giữa các base nitrogen trong chuỗi ADN giúp tạo ra cấu trúc xoắn kép của ADN, cho phép lưu trữ thông tin di truyền.
👉 Tóm lại, cả hai loại liên kết hidro liên phân tử và nội phân tử đều có vai trò quan trọng trong việc xác định tính chất và cấu trúc của các hợp chất. Liên kết hidro liên phân tử giúp tạo thành các chất lỏng và cấu trúc đa phân tử như nước, trong khi liên kết hidro nội phân tử giúp duy trì hình dạng và chức năng của các phân tử sinh học lớn.
V. Liên kết hydrogen và tương tác Van der Waals
Trong hóa học, ngoài liên kết hóa học chính thức như ion hay cộng hóa trị, còn tồn tại nhiều dạng tương tác yếu giữa các phân tử, trong đó phổ biến nhất là liên kết hydrogen và tương tác Van der Waals. Hai loại liên kết này tuy đều yếu, nhưng có bản chất và vai trò khác nhau.
1. Sự khác biệt cơ bản
| Tiêu chí | Liên kết hydrogen | Tương tác Van der Waals |
|---|---|---|
| Bản chất | Lực hút tĩnh điện có định hướng | Lực hút tạm thời do dao động điện tích |
| Đối tượng tham gia | H liên kết với O, N, hoặc F | Bất kỳ phân tử nào, ngay cả không phân cực |
| Cường độ liên kết | 2–10 kcal/mol | < 2 kcal/mol |
| Tính định hướng | Có (liên kết theo một hướng nhất định) | Không có định hướng rõ ràng |
| Ứng dụng tiêu biểu | Nước, ADN, protein | Các chất khí, chất lỏng không phân cực |
2. Vai trò bổ sung lẫn nhau
Liên kết hydrogen thường xuất hiện trong các hệ thống có tính phân cực cao, và giữ vai trò chủ đạo trong việc duy trì cấu trúc không gian của các phân tử sinh học như ADN, protein, tinh bột, v.v.
Tương tác Van der Waals, tuy yếu hơn nhưng lại rất phổ biến. Chúng giúp các phân tử không phân cực (như khí hiếm, dầu, sáp…) ngưng tụ thành chất lỏng hoặc rắn ở nhiệt độ thấp. Trong nhiều trường hợp, tổng số lượng lớn các tương tác Van der Waals cũng có thể tạo ra ảnh hưởng đáng kể.
3. Ví dụ minh họa
Trong một phân tử ADN, các liên kết hidro giữa các base duy trì hình xoắn kép, còn tương tác Van der Waals giữa các mặt phẳng base giúp ổn định cấu trúc này hơn nữa.
👉 Tóm lại, mặc dù đều là các lực liên kết yếu, liên kết hydrogen và tương tác Van der Waals đóng những vai trò riêng biệt và quan trọng trong việc hình thành, duy trì và điều chỉnh cấu trúc của các phân tử hóa học và sinh học.
VI. Ví dụ về liên kết hydrogen trong đời sống và sinh học
Liên kết hydrogen (liên kết hidro) không chỉ là khái niệm lý thuyết trong sách giáo khoa, mà còn xuất hiện rất phổ biến trong thực tế và đóng vai trò quan trọng trong cả hóa học lẫn sinh học. Dưới đây là những ví dụ tiêu biểu giúp bạn dễ hình dung hơn:
1. Nước – dung môi kỳ diệu của sự sống
Trong nước, các phân tử liên kết với nhau bằng liên kết hidro, tạo nên mạng lưới phân tử bền vững.
Điều này giải thích cho:
- Nhiệt độ sôi cao bất thường so với các phân tử có cùng khối lượng.
- Tính chất mao dẫn (nước dâng lên trong rễ cây).
- Sức căng bề mặt lớn (giọt nước hình cầu, côn trùng đi trên nước).
2. ADN – vật liệu di truyền của sự sống
Cấu trúc xoắn kép của ADN được duy trì nhờ các liên kết hidro giữa các cặp base:
- Adenin (A) – Timin (T): 2 liên kết H
- Guanin (G) – Xytosin (C): 3 liên kết H
Nhờ các liên kết này, ADN vừa bền vững vừa dễ sao chép trong quá trình nhân đôi.
3. Protein – phân tử chức năng của tế bào
Các liên kết hidro nội phân tử giúp protein gấp khúc và ổn định cấu trúc không gian ba chiều.
Điều này cực kỳ quan trọng vì hình dạng quyết định chức năng của protein (enzyme, kháng thể, hormone…).
4. Tinh bột và cellulose
Trong cellulose (cấu tạo thành vách tế bào thực vật), các chuỗi phân tử liên kết với nhau nhờ liên kết hidro, giúp tạo thành cấu trúc bền vững và khó tiêu hóa.
Trong tinh bột, liên kết hidro cũng giúp ổn định cấu trúc xoắn của phân tử.
5. Một số ứng dụng khác
- Polyme siêu thấm nước (superabsorbent) sử dụng liên kết hidro để hút và giữ nước.
- Thuốc nhuộm, mỹ phẩm, chất giữ ẩm da tận dụng khả năng tạo liên kết H của phân tử để gắn kết hoặc cấp ẩm.
👉 Tóm lại, liên kết hydrogen không chỉ là kiến thức cơ bản trong hóa học, mà còn hiện diện khắp nơi trong tự nhiên và công nghệ – từ giọt nước bạn uống mỗi ngày, đến cấu trúc ADN trong cơ thể, hay các loại mỹ phẩm bạn sử dụng.
VII. Lời kết
Liên kết hidro, tuy chỉ là một liên kết yếu, nhưng lại đóng vai trò vô cùng quan trọng trong cả hóa học và sinh học. Từ việc quyết định các tính chất đặc biệt của nước, đến việc giữ vững cấu trúc của ADN và protein, liên kết hydrogen đã chứng minh rằng những điều nhỏ bé cũng có thể tạo nên sức mạnh to lớn.
Việc hiểu rõ liên kết hidro là gì, cách chúng hình thành, phân loại và tác động đến thế giới tự nhiên sẽ giúp học sinh, sinh viên có nền tảng vững chắc để khám phá sâu hơn các lĩnh vực như hóa sinh, công nghệ sinh học, y học phân tử hay thậm chí là vật liệu học.