Ethanol là một trong những hợp chất hữu cơ quen thuộc nhất trong đời sống con người. Từ ly rượu vang trong bữa tiệc, chai nước rửa tay sát khuẩn, đến nhiên liệu sinh học dùng cho xe hơi — tất cả đều có sự góp mặt của ethanol. Vậy ethanol là gì, nó được tạo ra như thế nào, có những tính chất hóa học và ứng dụng thực tế ra sao? Hãy cùng tìm hiểu chi tiết trong bài viết này.
I. Ethanol là gì?
1. Khái niệm ethanol
Ethanol (tên gọi khác là rượu etylic hay cồn etylic) là một hợp chất hữu cơ có công thức phân tử C₂H₅OH. Đây là một ancol no, đơn chức, mạch hở — nghĩa là trong phân tử có nhóm –OH (hiđroxyl) gắn vào nguyên tử cacbon bão hòa.
Hình ảnh minh hoạt cho Ethanol trong phòng thí nghiệm
Ethanol là chất lỏng không màu, dễ bay hơi, có mùi đặc trưng và vị cay nồng. Nó là thành phần chính của các loại đồ uống có cồn và cũng là nguyên liệu quan trọng trong công nghiệp.
2. Công thức cấu tạo của ethanol
Công thức cấu tạo của ethanol là:
👉 CH₃–CH₂–OH
Nhóm –OH chính là nhóm chức của ancol, quyết định các tính chất hóa học đặc trưng của ethanol, như phản ứng với kim loại kiềm hay phản ứng cháy tạo CO₂ và H₂O.
3. Dãy đồng đẳng của ethanol
Ethanol thuộc dãy ancol no:
CH₃OH (methanol) – C₂H₅OH (ethanol) – C₃H₇OH (propanol) – …
Trong đó, methanol rất độc, có thể gây mù hoặc tử vong nếu uống phải, còn ethanol có thể uống được (trong giới hạn an toàn).
II. Tính chất của ethanol
1. Tính chất vật lý
Trạng thái: chất lỏng không màu, dễ bay hơi.
Tan vô hạn trong nước do có liên kết hiđro.
Nhiệt độ sôi: 78,3°C.
Mùi đặc trưng, vị cay nồng.
Khi hòa tan vào nước có hiện tượng tỏa nhiệt nhẹ.
Nhờ đặc điểm này, ethanol được dùng phổ biến trong sản xuất mỹ phẩm, nước hoa, dung môi và đồ uống có cồn.
2. Tính chất hóa học
Do có nhóm –OH nên ethanol có các tính chất đặc trưng của ancol:
a. Phản ứng với kim loại kiềm
Ethanol phản ứng với natri (Na) hoặc kali (K) tạo muối ancolat và khí hiđro:
2C₂H₅OH + 2Na → 2C₂H₅ONa + H₂↑
Phản ứng này chứng minh trong ethanol có nguyên tử hiđro linh động.
b. Phản ứng tách nước (đề hiđrat hóa)
Tùy điều kiện, ethanol có thể tách nước tạo ete hoặc etilen:
Ở 140°C, có xúc tác H₂SO₄ đặc → ete etylic
2C₂H₅OH → C₂H₅–O–C₂H₅ + H₂O
Ở 170°C, có xúc tác axit → etilen (C₂H₄)
C₂H₅OH → C₂H₄ + H₂O
c. Phản ứng oxi hóa
Oxi hóa nhẹ:
C₂H₅OH + [O] → CH₃CHO + H₂O (andehit axetic)
Oxi hóa hoàn toàn (cháy):
C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O
Phản ứng cháy này tỏa nhiều nhiệt và cho ngọn lửa màu xanh nhạt, không khói.
III. Cách điều chế ethanol
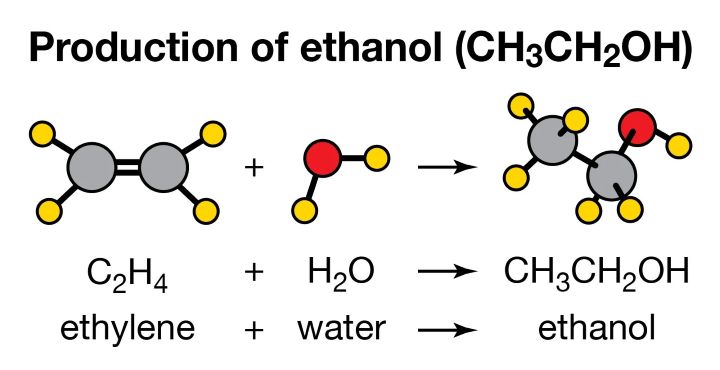
1. Trong phòng thí nghiệm
Ethanol có thể được điều chế từ etilen (C₂H₄) bằng phản ứng cộng nước có xúc tác axit:
Hình ảnh minh họa phản ứng tổng hợp ethanol trong PTN
C₂H₄ + H₂O → C₂H₅OH
Đây là cách điều chế tổng hợp phổ biến trong công nghiệp hiện đại.
2. Trong công nghiệp (lên men sinh học)
Phương pháp truyền thống là lên men tinh bột hoặc đường nhờ vi sinh vật (men rượu):
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂
Nguồn nguyên liệu thường là mía, ngô, sắn, khoai tây hoặc gạo.
Sản phẩm thu được là rượu etylic có nồng độ khác nhau (5% – 95%) tùy quá trình chưng cất.
3. Sản xuất bioethanol
Ngày nay, ethanol còn được sản xuất từ sinh khối (biomass) như rơm rạ, bã mía, gỗ vụn.
Bioethanol được xem là nguồn năng lượng tái tạo, thân thiện môi trường, góp phần giảm phát thải khí nhà kính.
IV. Ứng dụng của ethanol
1. Trong đời sống
Thành phần chính của đồ uống có cồn như bia, rượu vang, rượu mạnh.
Dung môi hữu cơ hòa tan được nhiều loại chất (sơn, hương liệu, thuốc).
Nguyên liệu trong mỹ phẩm, nước hoa, nước rửa tay.
Dùng để sát khuẩn vết thương, khử trùng dụng cụ y tế.
2. Trong công nghiệp
Là nguyên liệu sản xuất axit axetic, etyl este, ete, sơn, vecni, dược phẩm.
Dùng trong nhiên liệu sinh học (xăng E5, E10) — hỗn hợp của xăng và ethanol giúp giảm ô nhiễm không khí.
Sử dụng trong công nghiệp hóa chất, dệt may, sơn, in ấn, chế tạo cao su nhân tạo.
3. Trong y học
Ethanol 70° – 90° được dùng phổ biến để khử trùng tay, dụng cụ phẫu thuật.
Là chất bảo quản sinh học, chống đông mẫu mô, chất nền trong thuốc xịt.
V. Tác hại của ethanol đối với sức khỏe
Mặc dù ethanol có nhiều ứng dụng hữu ích, nhưng việc lạm dụng hoặc sử dụng sai cách có thể gây nguy hiểm cho sức khỏe:
Ảnh hưởng hệ thần kinh trung ương → say rượu, mất kiểm soát hành vi.
Uống lâu dài → xơ gan, tim mạch, viêm loét dạ dày, suy giảm trí nhớ.
Gây nghiện rượu (alcoholism), ảnh hưởng đến đời sống xã hội và tinh thần.
Không nên nhầm ethanol với methanol (CH₃OH), vì methanol cực độc, chỉ cần vài ml cũng có thể gây mù hoặc tử vong.
VI. Vai trò của ethanol trong năng lượng xanh
Ethanol ngày càng đóng vai trò quan trọng trong chiến lược năng lượng tái tạo toàn cầu.
Khi pha vào xăng theo tỉ lệ (E5, E10, E20), ethanol giúp:
Giảm khí thải CO₂, CO, HC chưa cháy hết.
Giảm phụ thuộc vào dầu mỏ.
Tận dụng phế phẩm nông nghiệp, tạo sinh kế cho người nông dân.
Tuy nhiên, vẫn còn thách thức như chi phí sản xuất cao, yêu cầu cải tiến động cơ, và nguy cơ cạnh tranh đất trồng lương thực.
VII. An toàn khi sử dụng và bảo quản ethanol
Bảo quản ethanol trong chai thủy tinh hoặc nhựa kín, tránh ánh sáng và nhiệt độ cao.
Không để gần nguồn lửa vì ethanol dễ cháy mạnh.
Khi tiếp xúc, nên đeo găng tay và khẩu trang để tránh kích ứng da hoặc mắt.
Nếu bị ngộ độc ethanol (do uống quá nhiều), cần đưa đến cơ sở y tế ngay để xử lý.
VIII. Lời kết
Ethanol là một hợp chất hữu cơ vô cùng quan trọng, hiện diện từ đời sống hàng ngày đến công nghiệp hiện đại. Với công thức C₂H₅OH, ethanol mang trong mình hai mặt: lợi ích to lớn và rủi ro nếu lạm dụng.
Từ việc sản xuất nhiên liệu sinh học bioethanol đến ứng dụng trong y học và mỹ phẩm, ethanol góp phần không nhỏ vào xu hướng phát triển bền vững của nhân loại.
👉 Hiểu đúng, dùng đúng ethanol chính là cách chúng ta tận dụng hiệu quả nguồn năng lượng sạch, thân thiện với môi trường — hướng đến một tương lai xanh hơn.